FDA未批准Materialise医疗3D打印膝盖指导解决方案
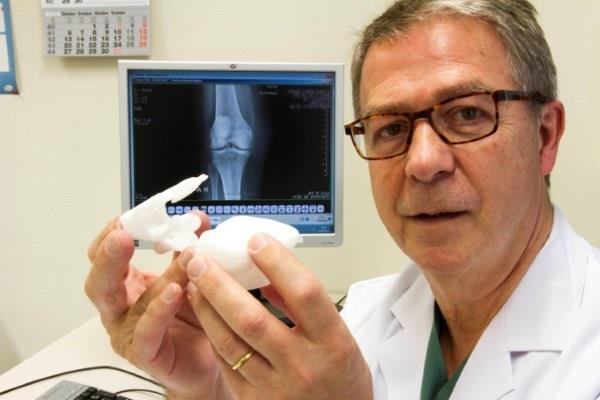
当时, 该公司宣布将继续评估这项技术,在欧洲限制性地推出相关产品,同时开始申请在美国市场的上市。不过就在昨天,他们却收到了一个坏消息:美国食品药品监督管理局(FDA)给他们寄来了一封“非实质等同” (NSE)信,没有批准他们的X-KGS预上市申请。这意味着在得到进一步的批准之前,该公司不能合法在美国市场销售他们的这项技术。

据中国3D打印网了解,所有想要在美国市场销售相关产品的公司都必须向FDA提交足够的产品上市前信息才能得到商业化批准,而Materialise此次的确提交了包含有与现有合法市场设备等价信息的510K申请。在这份申请中,Materialise认为他们的X光膝盖指导方案与自己现有的3D手术规划解决方案是实质等同的,因为包含了基于CT或MRI图像的自定义膝盖置换解决方案的后者已经得到了FDA的批准。不过从目前的结果来看,显然FDA并不认为二者的信息是“实质等同”的。
“我们对FDA的结论表示失望。很显然,他们并不认为X-KGS和我们之前的解决方案是等同的,”Materialise的CEO兼创始人Wilfried Vancraen表示,“虽然这会影响我们的新技术在美国的上市时间,但我们还是会遵循规范的申请程序,继续申请直到获得批准。”

尽管此次遭到挫折,不过Materialise毕竟是一家实力雄厚的大企业。相信用不了多久,他们就会得到FDA的批准,从而将自己的新技术带入美国市场。
上一篇:美国残疾小伙众筹3D打印机欲为伤残军人制作假肢[ 12-23 ]
下一篇:Pandorum成印度首家成功3D打印肝组织的公司[ 12-23 ]






